L’ossigenoterapia iperbarica: definizione e campi di applicazione.

L’ossigenoterapia iperbarica (HBOT) è un approccio terapeutico basato sull’esposizione a concentrazioni pure di ossigeno (O2) in una pressione atmosferica aumentata. Secondo la Undersea and Hyperbaric Medical Society (UHMS), questa pressione può essere pari o superiore a 1,4 atmosfere (atm) [1].
La UHMS è un’organizzazione americana senza scopo di lucro con connessioni internazionali provenienti da più di 35 paesi e fonte primaria di informazioni scientifiche per la fisiologia della medicina subacquea e iperbarica in tutto il mondo.
Il trattamento iperbarico a pressioni della camera minimamente elevate (ossigeno iperbarico moderato) non è dimostrato con studi scientifici. Attualmente sono considerate terapie “leggere” quelle effettuate a pressioni inferiori a 1,5 ATM. La maggior parte dei pazienti ricevono miscele di gas respiratori ben inferiori al 95% di O2, spesso erogate attraverso dispositivi di respirazione come maschere, che non forniscono una tenuta ermetica e per la natura della loro costruzione consentono la miscelazione dei gas con l’aria ambiente della camera, riducendo ulteriormente la concentrazione di ossigeno. Questi trattamenti sono diventati ampiamente disponibili nei cosiddetti “centri benessere”, al di fuori dell’ambito delle strutture mediche e generalmente non prescritti o supervisionati dal medico (1).
Ruolo fisiologico dell’ossigeno nell’organismo
L’ossigeno (O2) è un nutriente spesso trascurato a causa del suo particolare accesso all’interno del corpo umano, attraverso i polmoni anziché per il tratto gastrointestinale, tipico di tutti gli altri nutrienti [9]. L’O2 è fondamentale affinché le cellule umane eseguano la cosiddetta respirazione aerobica, che avviene nei mitocondri. Agisce come un accettore di elettroni portando infine alla sintesi di ATP in un processo noto come fosforilazione ossidativa.
In modo semplice, l’ossigeno viene introdotto nel nostro corpo attraverso due processi distinti: la ventilazione, in cui i gas vengono trasportati dall’ambiente all’albero bronchiale, e la diffusione, dove viene raggiunto un equilibrio nella sua distribuzione tra gli spazi alveolari e il sangue. Dato che la pressione parziale di O2 (PO2) qui è bassa e ricca di anidride carbonica (CO2), avviene uno scambio di gas [12]. Allo stesso tempo, la differenza di pressione e volume nella parete toracica e nei polmoni sono essenziali per consentirne il flusso, poiché la pressione atmosferica non varia [13]. Una volta nel flusso sanguigno, l’O2 è principalmente legato all’emoglobina (Hb) negli eritrociti e, in piccola misura, in forma disciolta, essendo distribuito a livello sistemico. Successivamente si produce uno scambio di ossigeno tra i vasi del microcircolo – non solo capillari, ma anche arteriole e venule – e il resto dei tessuti, a causa della diversa pressione parziale e della saturazione di O2 dell’Hb (SO2), che dipende anche dalle altre variabili come temperatura, PCO2 e pH [14].
Se invece ce n’è una carenza nel tessuto può verificarsi una condizione denominata ipossia. Ciò può essere dovuto a un basso contenuto di O2 nel sangue (ipossiemia), che può essere una conseguenza di un’interruzione del flusso sanguigno ai polmoni (perfusione), del flusso d’aria agli alveoli (ventilazione) o di problemi nella diffusione del gas nella barriera emato-alveolare.
Inoltre, anche un basso apporto di sangue (ischemia) o difficoltà nel rilascio di ossigeno possono essere responsabili dell’ipossia tissutale [15]. Di conseguenza, all’interno delle cellule sono presenti sensori specifici chiamati fattori inducibili (Hypoxia-inducible factors, HIF) che in queste condizioni si legano all’elemento di risposta all’ipossia (hypoxia response element,HRE), regolando così un’ampia varietà di processi cellulari [16].
Il regolatore centrale del rilevamento e dell’adattamento dell’ossigeno a livello cellulare è il fattore inducibile dall’ipossia (HIF), un fattore di trascrizione. Quest’ultimo attiva i geni che controllano l’omeostasi dell’ossigeno cellulare, compresi quelli coinvolti nel consumo di O2, nella produzione di eritrociti, nell’angiogenesi e nel metabolismo mitocondriale. Le cellule ipossiche contrastano lo stress mediante meccanismi trascrizionali e post-trascrizionali, regolati principalmente dall’HIF. Questi cambiamenti molecolari consentono alle cellule di adattarsi allo stress riducendo il consumo di ossigeno attraverso il passaggio alla glicolisi anziché al metabolismo ossidativo, riducendo la domanda di energia per processi cellulari come la divisione (Ratcliffe, 2013).
Choudhry H, Harris AL. Advances in Hypoxia-Inducible Factor Biology. Cell Metab. 2018 Feb 6;27(2):281-298. doi: 10.1016/j.cmet.2017.10.005. Epub 2017 Nov 9. PMID: 29129785.
Occasionalmente l’ipossia potrebbe fornire implicazioni favorevoli per la salute, ad esempio durante le prime fasi dello sviluppo [17] o nel caso di esposizioni intermittenti [18].
Tuttavia, questa condizione induce nella maggior parte dei casi uno stress patologico per le cellule che è strettamente correlato alla comparsa e al progresso di un ampio spettro di malattie [19]. Di conseguenza l’ossigeno è stato proposto come potenziale agente terapeutico per i pazienti sottoposti a diverse fasi acute o condizioni croniche [20,21]. Poiché il targeting dell’ipossia cellulare è un approccio promettente, ma ancora emergente [22], la sua gestione clinica è diretta a modulare l’ipossiemia globale e il rilascio di ossigeno all’interno dei tessuti [23]. In questo contesto, l’ossigenoterapia iperbarica si pone come uno straordinario supporto nella sua gestione e di altri fenomeni correlati aumentando i livelli di O2 nel sangue e nei tessuti [24].
Principi di ossigenoterapia iperbarica. Base terapeutica
L’HBOT consiste nel fornire di ossigeno puro sotto pressione aumentata. Questa procedura viene condotta in una camera monoposto o multiposto se vi sono rispettivamente solo uno o più pazienti sottoposti a questa procedura. Nel primo caso, le camere sono solitamente compresse con O2, mentre nella seconda le persone respirano ossigeno individualmente attraverso una maschera facciale, un cappuccio o un tubo endotracheale [25]. Nel caso di condizioni critiche, sembra che le camere multiposto permettano un migliore monitoraggio delle funzioni vitali rispetto a quelle monoposto, sebbene l’utilizzo di queste ultime sia anche sicuro e ben tollerato dai pazienti [26,27]. A seconda del protocollo, la durata stimata della sessione varia da 1,5 a 2 ore e può essere eseguita da una a tre volte al giorno, somministrando da 20 a 60 dosi terapeutiche a seconda della condizione [28].
Spesso questo metodo utilizza da 2 a 3 atm di pressione. Tuttavia, sono stati ottenuti risultati promettenti anche in alcuni studi da <2 atm (1,5 atm) per determinate condizioni [29,30], sebbene secondo tutte le indicazioni UHMS attualmente approvate sia necessaria una camera pressurizzata ad un minimo di 2 ATA [ 2].
Nonostante alcuni protocolli accettino l’uso di 6 atm (ad esempio, il trattamento dell’embolia gassosa), di solito si riportano scarsi benefici da più di 3 atm, in quanto potrebbero essere associati a una serie di effetti avversi [31]. Inoltre, non è possibile respirare O2 puro a pressioni superiori a 2,8 atm, e in questi casi è accompagnato da altri gas come elio, azoto o ozono. L’alternativa, l’ossigenoterapia normobarica (normobaric oxygen therapy, NBOT), utilizza l’ossigeno a 1 atm di pressione. Rispetto all’HBOT, l’NBOT è più economico e facile da applicare, e può essere trovato in quasi tutti gli ospedali, poiché non richiede camere iperbariche [32]. Tuttavia, alcuni studi hanno riportato una ridotta efficacia dell’NBOT rispetto all’HBOT [33,34], dimostrando quindi la rilevanza dell’HBOT per determinate condizioni. Al contrario, l’uso di NBOT potrebbe essere fondamentale per i pazienti che soffrono di alcune malattie in assenza di strutture HBOT.
Come ad esempio nell’emicrania, l’HBOT può essere efficace per la risoluzione delle forme più acute ed esistono alcune prove che l’NBOT fosse altrettanto efficace nella cefalea a grappolo. Dato il costo e la scarsa disponibilità dell’HBOT, dovrebbero essere condotte ulteriori ricerche sui pazienti che non rispondono alla terapia standard. NBOT è economico, sicuro e facile da applicare, quindi probabilmente continuerà ad essere utilizzato nonostante le prove limitate.
Bennett MH, French C, Schnabel A, Wasiak J, Kranke P, Weibel S. Normobaric and hyperbaric oxygen therapy for the treatment and prevention of migraine and cluster headache. Cochrane Database Syst Rev. 2015 Dec 28;2015(12):CD005219. doi: 10.1002/14651858.CD005219.pub3. PMID: 26709672; PMCID: PMC8720466.
Le basi terapeutiche dell’ossigenazione iperbarica sono la conseguenza di tre fattori principali:
(1) Respirando il 100% di O2, si crea un gradiente positivo, favorendo quindi la diffusione dai polmoni iperossigenati ai tessuti ipossici;
(2) a causa dell’alta pressione, la concentrazione di ossigeno nel sangue aumenta secondo la legge di Henry (la quantità di gas disciolto in un liquido è direttamente proporzionale alla sua pressione parziale)
(3) diminuisce la dimensione delle bolle di gas nel sangue secondo la legge di Boyle-Mariotte e la legge di Henry [6] .
In altre parole, la creazione di un ambiente iperbarico con ossigeno puro consente un incremento significativo dell’apporto di ossigeno al sangue (iperossiemia) e ai tessuti (iperossia) anche senza l’apporto dell’emoglobina Hb [35]. Pertanto, l’HBOT fornisce molteplici effetti nell’organismo e potrebbe essere utilizzato per correggere l’ipossia tissutale, l’ipossiemia cronica e per aiutare nella gestione clinica di diversi processi patologici tra cui la guarigione delle ferite, la necrosi o le lesioni da riperfusione [36].
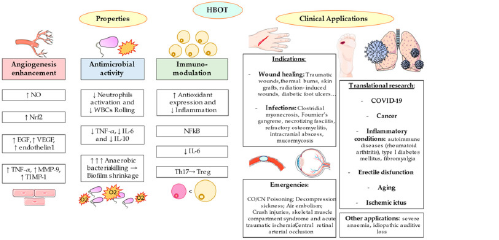
Contrariamente all’ipossia, il corpo umano non ha sviluppato alcun adattamento specifico all’iperossia. È interessante notare che l’esposizione all’iperossia intermittente condivide molti dei mediatori e dei meccanismi cellulari indotti dall’ipossia. Questo è chiamato il paradosso iperossico-ipossico [37]. È importante sottolineare che non deve essere considerato un aspetto negativo. Come accade con l’ipossia intermittente, la presentazione di iperossia a breve termine può fornire esiti favorevoli nella cellula. La spiegazione risiede in un concetto cruciale in biologia, l’ormesi, che correla il tipo di risposta ottenuta con la dose ricevuta [38]. Da un punto di vista molecolare, un’elevata PO2 nei tessuti può avere importanti implicazioni nella segnalazione cellulare, in particolare attraverso l’aumento della produzione di specie reattive dell’ossigeno (ROS) e delle specie reattive dell’azoto (RNS). Questi cambiamenti inducono molti effetti nell’organismo, inclusa la sintesi di diversi fattori di crescita, il miglioramento della neo-vascolarizzazione o la dimostrazione di proprietà immunomodulatorie tra gli altri, esercitando quindi la sua efficacia clinica [39,40]. Inoltre, l’HBOT sovra regola l’HIF, attraverso la via ROS/RNS e le chinasi extracellulari regolate (ERK1/ERK2) [37,41]. Allo stesso modo, una produzione eccessiva di ROS e RNS dovuta all’iperossia può portare alla comparsa di stress ossidativo, danno al DNA, disturbi metabolici, disfunzione endoteliale, danno polmonare acuto e neurotossicità [42]. Poiché l’O2 iperbarico può fornire sia effetti benefici che avversi, è essenziale bilanciare i diversi fattori per raccomandare o sconsigliare clinicamente l’HBOT [43]. A causa della fisica dell’HBOT, non è facile progettare studi adeguati e studi clinici per approvarne pienamente l’uso.
Nonostante ciò, ci sono alcuni modelli predittivi che possono essere uno strumento aggiuntivo per valutare quali pazienti potrebbero trarre il massimo beneficio dal ricevere questa terapia, considerando approcci terapeutici distinti, se necessario [44].
Nella Figura 1
Ortega MA, Fraile-Martinez O, García-Montero C, Callejón-Peláez E, Sáez MA, Álvarez-Mon MA, García-Honduvilla N, Monserrat J, Álvarez-Mon M, Bujan J, Canals ML. A General Overview on the Hyperbaric Oxygen Therapy: Applications, Mechanisms and Translational Opportunities. Medicina (Kaunas). 2021 Aug 24;57(9):864. doi: 10.3390/medicina57090864. PMID: 34577787; PMCID: PMC8465921.
Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).
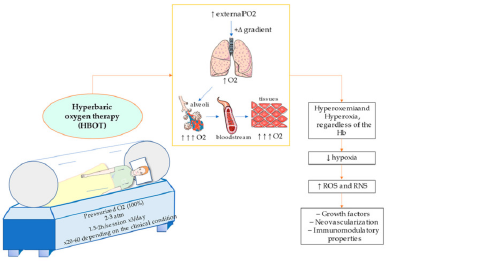
Illustrazione di una camera iperbarica monoposto e dell’effetto dell’O2 iperbarico. L’ossigeno pressurizzato (2–3 atm) alla concentrazione del 100%, viene somministrato normalmente per 1,5–2 ore per sessione e ripetuto tre volte al giorno. A seconda della condizione clinica le sedute variano in numero, da 20 a 60. L’aria inspirata proviene da una PO2 esterna elevata, quindi il gradiente positivo consente un maggiore ingresso di O2, che per diffusione sarà maggiore anche negli alveoli, nel circolo sanguigno e quindi ci sarà maggiore arrivo ai tessuti. Questo effetto di “iperossiemia” e “iperossia” è indipendente dall’emoglobina (Hb), quindi diminuirà quest’ultima nei tessuti. Ciò si tradurrà in un maggiore apporto di specie reattive dell’ossigeno (ROS) e di specie reattive dei nitriti (RNS), con una conseguente maggiore espressione di fattori di crescita e promozione della neo-vascolarizzazione e proprietà immunomodulatorie potenziate.
Radicaliliberi ROS e RNS
In condizioni fisiologiche, piccole quantità di ROS e RNS si formano durante processi cellulari, come la respirazione aerobica o processi infiammatori, principalmente negli epatociti e nei macrofagi. Le specie reattive dell’ossigeno sono principalmente molecole di segnalazione. Inoltre, inducono la differenziazione cellulare e l’apoptosi, contribuendo così al naturale processo di invecchiamento. Partecipano inoltre alle contrazioni muscolari, alla regolazione del tono vascolare e determinano l’attività battericida e batteriostatica. L’aumento della produzione di radicali liberi è causato da un’eccessiva esposizione ai raggi UV, da condizioni di stress a lungo termine, da un intenso esercizio fisico, da una dieta scorretta e dall’uso di stimolanti. In condizioni fisiologiche, esiste un equilibrio tra la generazione e la rimozione dei radicali liberi dal corpo, lo Stress Ossidativo, ed i suoi effetti negativi si verificano quando il rapporto di produzione dei radicali e loro neutralizzazione si sbilancia a favore dei primi.
Jakubczyk K, Dec K, Kałduńska J, Kawczuga D, Kochman J, Janda K. Reactive oxygen species – sources, functions, oxidative damage. Pol Merkur Lekarski. 2020 Apr 22;48(284):124-127. PMID: 32352946.
HBOT e infiammazione: proprietà immunomodulatorie
L’HBOT potrebbe anche essere applicato nella regolazione delle risposte infiammatorie e delle complicanze che ne derivano. Tra gli effetti immunomodulatori più importanti, l’HBOT determina un’alterazione del rapporto CD4+:CD8+, una ridotta proliferazione dei linfociti e un’attivazione dei neutrofili con migrazione verso regioni iperossiche [124].
Allo stesso modo, questi risultati potrebbero essere estrapolati ad altre condizioni. Ad esempio, l’HBOT fornisce una risposta antinfiammatoria nella colite. Attraverso effetti diretti sull’HIF, l’HBOT induce l’espressione antiossidante e la downregulation delle citochine proinfiammatorie come IL-6, riducendo quindi l’infiammazione del colon [129].
È interessante notare che Woo et al. [133] hanno anche osservato che l’HBOT potrebbe essere considerata un’alternativa interessante per attenuare l’infiammazione e il danno muscolare indotti dall’esercizio.
Ci sono inoltre alcune prove scientifiche che supportano il ruolo di L’HBOT nell’inibizione della crescita del tumore e del successo della terapia, attraverso tre meccanismi principali:
(1) Limitando l’ipossia associata al cancro
(2) Attraverso la generazione di ROS e RNS
(3) Ripristinando la funzione immunitaria [161].
Le indagini attuali mostrano il ruolo promettente dell’HBOT in un’ampia varietà di tumori maligni, tra cui cancro al seno, alla prostata, alla testa e al collo, del colon-retto, leucemia, tumori cerebrali, cervicale e della vescica [162]. Le principali applicazioni derivate dall’HBOT in oncologia possono essere (a) come parte del trattamento (b) come adiuvante della radioterapia e (c) come adiuvante della chemioterapia [163].
Tuttavia, l’uso dell’HBOT come parte della terapia antitumorale non è attualmente un’indicazione approvata, sebbene recentemente siano emersi alcuni risultati promettenti.
Ortega MA, Fraile-Martinez O, García-Montero C, Callejón-Peláez E, Sáez MA, Álvarez-Mon MA, García-Honduvilla N, Monserrat J, Álvarez-Mon M, Bujan J, Canals ML. A General Overview on the Hyperbaric Oxygen Therapy: Applications, Mechanisms and Translational Opportunities. Medicina (Kaunas). 2021 Aug 24;57(9):864. doi: 10.3390/medicina57090864. PMID: 34577787; PMCID: PMC8465921.
Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).
Le due più comuni complicanze durante l’HBOT sono claustrofobia e barotrauma. Entrambi si verificano durante la compressione della camera monoposto o multiposto [200]. Nel caso del barotrauma, potrebbe essere definito come una lesione causata dall’incapacità di equalizzare la pressione di uno spazio contenente aria e dell’ambiente circostante. Il barotrauma dell’orecchio è la condizione più frequente che colpisce quello medio, sebbene possano essere segnalati anche barotraumi sinusali/paranasali, dentali o polmonari [201]. Nonostante l’incidenza di questa complicanza sia estremamente rara [202], la sua gravità dovrebbe essere presa in considerazione, considerando la storia clinica dei pazienti a rischio di soffrire di queste complicanze.
D’altra parte, ci sono alcune condizioni in cui l’HBOT potrebbe essere assolutamente o relativamente controindicato. Il primo caso è rappresentato esclusivamente dallo pneumotorace non trattato, in quanto potrebbe rappresentare una procedura pericolosa per la vita [209]. Il resto delle controindicazioni sono relative, la sua indicazione dipenderà dalla reale necessità di questa terapia e dalle indicazioni mediche.
