Lesione muscolare: richiusura e ricostruzione del tessuto

Il muscolo scheletrico è organizzato in miofibre allungate e allineate che possono accorciarsi rapidamente per suscitare movimenti “su richiesta” (1).
Le miofibre sono cellule individuali, racchiuse in un’unica membrana plasmatica con molti nuclei per fibra (1), che si localizzano alla periferia delle miofibre. Il citoplasma di quest’ultime è dominato da una serie quasi cristallina di unità contrattili (sarcomeri) (1). La contrazione muscolare ripetitiva o eccessiva può interrompere o danneggiare la membrana plasmatica delle miofibre, innescando processi di riparazione cellulare (1), mentre le loro grandi dimensioni consentono anche la visualizzazione in tempo reale della riparazione cellulare (1).
Dopo una lesione muscolare, le miofibre a, rispettivamente 5 e 24 ore dopo l’esercizio, mostrano regioni arricchite di filamina C (proteina simile all’actina o filamina-2, partecipa alla ricostruzione muscolare), suggerendo che il danno al sarcomero si risolve rapidamente. Le cicatrici di filamina C e delle Heat shock protein (Hsp27) appaiono entro 30 minuti dopo l’esercizio, soprattutto se svolto in modo eccentrico (2).
Quindi la “cicatrice” che si genera formata da accumuli di proteine è arricchita con filamina C e proteina da shock termico 27 (HSP27). È possibile assistere, inoltre, alla formazione adiacente ai siti di lesione, di hotspot traslazionali come risultato dello spostamento dei nuclei dei miotubi verso il sito di lesione, con RNA messaggeri (mRNA) che codificano per proteine presenti nelle cicatrici, di filamina C e HSP27, e si sovrappongono con questi punti hotspot traslazionali (2).
Quest’ultimi sono il risultato dello spostamento dei nuclei dei miotubi verso il sito della lesione, ricordando che un miotubo è un tipo di cellula che si svilupperà in una fibra muscolare (2).
Gravi lesioni, ad esempio dopo un trauma o un intervento chirurgico, distruggono l’architettura muscolare (1).
Ciò richiede la rigenerazione muscolare, che è mediata da cellule staminali intrinseche al muscolo o cellule satellite (1). Quest’ultime contribuiscono alla crescita del muscolo durante i periodi di sviluppo o dopo gravi lesioni in cui l’architettura muscolare è stata distrutta (1).
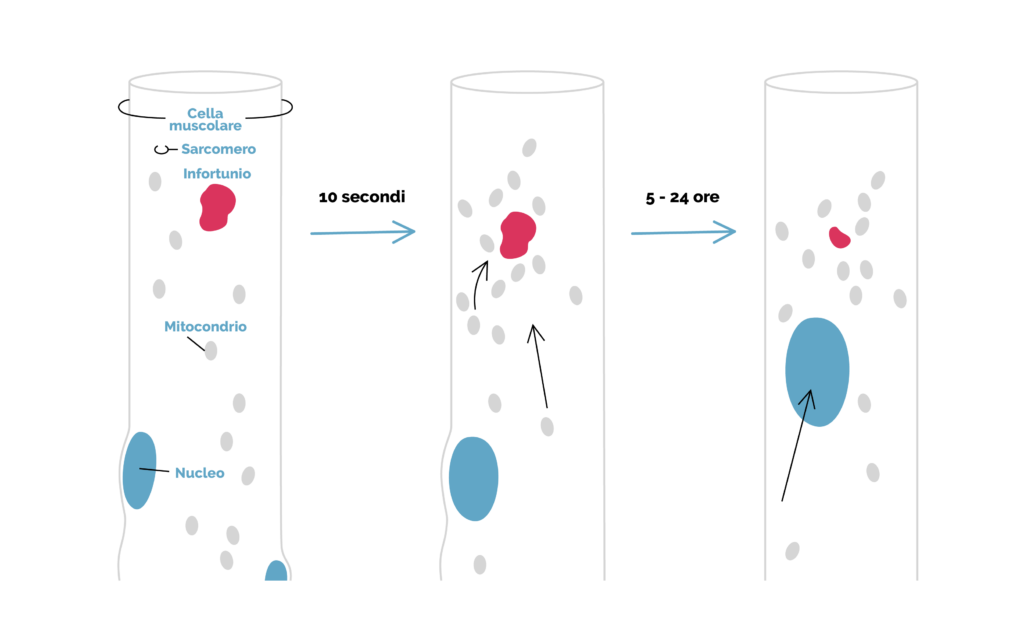
Tuttavia, nelle forme meno gravi di danno muscolare, i processi di riparazione cellulare sono indipendenti dalla rigenerazione mediata dalle cellule staminali (1). In questo paradigma di lesione lieve, in pochi secondi il calcio si accumula all’interno della miofibra adiacente al sito di rottura della membrana (1).
Anche le proteine di richiusura vengono inserite immediatamente nel sito della lesione, comprese le annessine (proteine che a livello cellulare sono stimolate dagli ioni calcio che si legano ai fosfolipidi di membrana cellulare, contribuendo a ripararla), la disferlina (proteina che partecipa alla riparazione della membrana plasmatica, alla stabilizzazione della segnalazione del calcio e allo sviluppo del sistema dei tubuli T del muscolo) e la mitsugumina-53 (MG53), una proteina della famiglia TRIM ( tripartite motif family) che svolge un ruolo chiave nella riparazione dei danni alla membrana cellulare e nel facilitare la rigenerazione dei tessuti (1).
Le annessine legano il calcio e molte altre tipologie (comprese le annessine A1, A2 e A6) formano un cappuccio sopra il sito lesionato; questi ultimi possono essere visualizzati entro 10 secondi dalla rottura della membrana (1). Inoltre, i mitocondri vicini al sito della lesione sono necessari per questa risigillazione iniziale e utili per ristabilire la ferita cellulare (1).
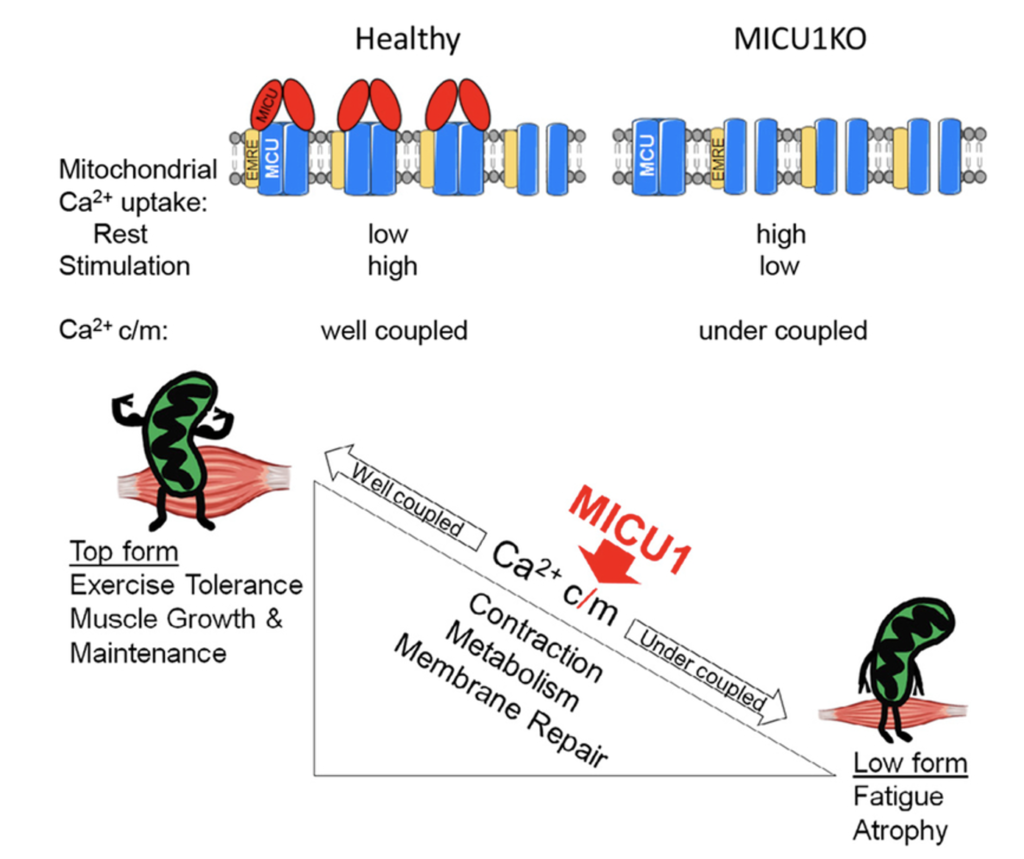
Debattisti et al. riportano che la perdita da parte del muscolo dell’assorbimento mitocondriale di Ca2+ 1 (MICU1) compromette la segnalazione (cell signalling) del calcio mitocondriale, il metabolismo energetico e la riparazione della membrana, portando a debolezza muscolare, affaticamento, danno alle miofibre e alti livelli di CK (3).
This is an open access article under the CC BY-NC-ND license http://creativecommons.org/licenses/by-nc-nd/4.0/ CC BY-NC-ND 4.0 DEED Attribution-NonCommercial-NoDerivs 4.0 International
Il danno della membrana induce, inoltre, la formazione di vescicole contenenti disferlina acida nelle fibre muscolari scheletriche adulte; quindi, la riparazione delle membrane plasmatiche delle fibre muscolari è mediata dalla disferlina e da annessina A1 e A2 (4).
Abbiamo perciò un decorso temporale della riparazione miocellulare, che inizia con una fase di chiusura immediata per sigillare urgentemente la membrana plasmatica mediante il cappuccio di riparazione dell’annessina (1). Dopo questa fase, segue la ricostruzione, che richiede la pulizia del calcio, l’introduzione di nuove proteine e la ricostruzione dei sarcomeri (1).
I mitocondri locali contribuiscono a questo processo attraverso molteplici meccanismi, incluso l’aiuto alla rimozione del calcio locale in eccesso. La rete intracellulare che supporta la ricostruzione miocellulare dipende dai microtubuli, mentre il processo di richiusura richiede actina (1). Le proteine risigillanti possono essere somministrate per promuovere una risoluzione più rapida delle rotture della membrana, migliorare l’infiammazione associata, la rigenerazione e la ricostruzione (1). La riparazione dei sarcomeri in tali casi si completa in circa 24 ore dopo la lesione (1).

References:
1. McNally EM, Demonbreun AR. Resealing and rebuilding injured muscle. Science. 2021 Oct 15;374(6565):262-263. doi: 10.1126/science.abm2240. Epub 2021 Oct 14. PMID: 34648349; PMCID: PMC9112225.
2. Roman W, Pinheiro H, Pimentel MR, Segalés J, Oliveira LM, García-Domínguez E, Gómez-Cabrera MC, Serrano AL, Gomes ER, Muñoz-Cánoves P. Muscle repair after physiological damage relies on nuclear migration for cellular reconstruction. Science. 2021 Oct 15;374(6565):355-359. doi: 10.1126/science.abe5620. Epub 2021 Oct 14. PMID: 34648328.
3. Debattisti V, Horn A, Singh R, Seifert EL, Hogarth MW, Mazala DA, Huang KT, Horvath R, Jaiswal JK, Hajnóczky G. Dysregulation of Mitochondrial Ca2+ Uptake and Sarcolemma Repair Underlie Muscle Weakness and Wasting in Patients and Mice Lacking MICU1. Cell Rep. 2019 Oct 29;29(5):1274-1286.e6. doi: 10.1016/j.celrep.2019.09.063. PMID: 31665639; PMCID: PMC7007691.
4. McDade JR, Archambeau A, Michele DE. Rapid actin-cytoskeleton-dependent recruitment of plasma membrane-derived dysferlin at wounds is critical for muscle membrane repair. FASEB J. 2014 Aug;28(8):3660-70. doi: 10.1096/fj.14-250191. Epub 2014 May 1. PMID: 24784578; PMCID: PMC4101652.
